-
科室:
神经外科
-
别名:
glioblastoma multiforme
胶质瘤
多形性恶性胶质瘤
-
症状:
头痛
呕吐
-
发病部位:
暂无
-
多发人群:
本病主要发生于成人, 成人中以45~65岁最为多发,30岁以下年轻患者少见
-
相关疾病:
暂无
胶质母细胞瘤是星形细胞肿瘤中恶性程度最高的胶质瘤,属WHO Ⅳ级。肿瘤位于皮质下,成浸润性生长,常侵犯几个脑叶,并侵犯深部结构,还可经胼胝体波及对侧大脑半球。发生部位以额叶最多见,其他依次为颞叶/顶叶,少数可见于枕叶/丘脑和基底节等。胶质母细胞瘤可原发于脑实质内,亦可呈继发性。继发性胶质母细胞瘤多数由间变性星形细胞瘤进一步恶变而来,少部分可由混合性胶质瘤、少枝胶质瘤或室管膜瘤演变而成。
目前有研究发现原发性胶质母细胞瘤与继发性胶质母细胞瘤的分子发生机制不同。原发性胶质母细胞瘤的分子改变以EGFR的扩增与过量表达为主,而继发性胶质母细胞瘤则以p53的突变为主要表现。
肿瘤好发于大脑半球白质内,浸润性生长,外观呈半球形分叶状,大多数肿瘤境界不清,少数肿瘤因生长迅速而使周围组织受压出现软化和水肿,表现“假包膜”现象,可被误以为境界清楚,其实肿瘤已超出边界浸润生长。肿瘤可侵犯皮质并可与硬膜粘连,或可突入脑室及深部结构。由于肿瘤浸润性扩张,胶质母细胞瘤常表现为多中心生长。但研究表明,真正多中心生长的胶质母细胞瘤只占2%~5%。肿瘤多沿神经纤维传导束生长,可沿胼胝体侵犯对侧脑组织,形成蝶形生长。同样通过沿丘脑间黏合生长,可出现双侧丘脑胶质母细胞瘤。 肿瘤的硬度因肿瘤有无继发性改变而异,一般软硬相间,质地不均。肿瘤可呈多种颜色,瘤内常有囊变、坏死及出血,钙化少见。典型肿瘤切面可见灰色的瘤体、红色的新鲜出血、紫色的出血块、黄色的陈旧出血和白色的间质增生,肿瘤亦可有大小不一的坏死灶和囊性变,囊内液体可呈血性、棕色、或黄色,也可为散在于肿瘤实质区内的多个小囊。肿瘤血运丰富,周围脑水肿明显。突出到脑表面和脑室者,肿瘤细胞可随脑脊液播散,个别的可向脑外转移至肺、肝、骨或淋巴结。 胶质母细胞瘤组织表现复杂,形态不一,同一肿瘤的不同部位亦不一致。根据WH0(1990)提出的分类标准,胶质母细胞瘤分为以下两个组织学亚型:①巨细胞型胶质母细胞瘤。②胶质肉瘤。这些亚型的提出,主要是根据肿瘤的某些比较突出的形态特征而定,与患者的预后无肯定的相应关系。 肿瘤细胞有多种组织学形态。增殖的肿瘤细胞常以小而深染的圆细胞为主,伴以间变的未分化的纤维性、原浆性与肥胖性星形细胞,另有大而怪异的来源不明的瘤细胞。肿瘤细胞直径相差悬殊,大者可达30μm以上,小者可能不足10μm。部分肿瘤胞质十分丰富,亦有胞质完全缺如而呈裸核者,核多形性并有较多分裂象。肿瘤坏死区被成堆狭长的肿瘤细胞层层环绕。肿瘤细胞核分裂象相当多见,并可见到单核或多核瘤巨细胞。供血的血管丰富,在肿瘤细胞增殖旺盛的区域内,可出现血管内皮细胞的异常增殖,形成围绕的血管球,与肾小球相似,构成胶质母细胞瘤镜下的另一个特征。来源于血管外膜细胞的间质纤维增生,严重者可成为肿瘤成分。 少数肿瘤可有蛛网膜下腔播散,10%~20%胶质母细胞瘤患者脑脊液中可发现肿瘤细胞。有软脑膜种植者约10%,尸检中达30%。开颅行肿瘤切除术后的患者极少数可发生肿瘤颅外转移。 电镜下肿瘤细胞大小形状不一,形态呈原始低分化,核大而周质少,细胞器稀少但多聚核糖体丰富。核不规则,核仁突出,常见核分裂象。巨细胞的细胞膜常有折叠,有时可见大量微绒毛,细胞器多少不固定,核畸形、多形、或分叶,高度不规则。巨细胞型胶质母细胞瘤的胞质极为宽阔,充满大量胶质丝,方向不定,成熟程度不一,线粒体散在其中。糖原丰富,核染色质与核仁突出,毛细血管和小血管内皮增生呈球状,使血管腔闭锁,大血管内皮都有增生,多层基膜包绕,大量胶质纤维产生。常见肿瘤细胞有不同程度的坏死,坏死灶中和血管周围常见巨噬细胞、成纤维细胞和其他炎性细胞。[收起]
肿瘤好发于大脑半球白质内,浸润性生长,外观呈半球形分叶状,大多数肿瘤境界不清,少数肿瘤因生长迅速而使周围组织受压出现软化和水肿,表现“假包膜”现象,可被误以为境界清楚,其实肿瘤已超出边界浸润生长。肿瘤可侵犯皮质并可与硬膜粘连,或可突入脑室及深部结构。由于肿瘤浸润性扩张,胶质母细胞瘤常表现为多中心生长。但研究表明,真正多中心生长的胶质母细胞瘤只占2%~5%。肿瘤多沿神经纤维传导束生长,可沿胼胝体侵犯对侧脑组织,形成蝶形生长。同样通过沿丘脑间黏合生长,可出现双侧丘脑胶质母细胞瘤。 肿瘤的硬度因肿瘤有无继发性改变而异,一般软硬相间,质地不均。肿瘤可呈多种颜色,瘤内常有囊变、坏死及出血,钙...[详细]
胶质母细胞瘤生长速度快、病程短,70%~80%患者病程在3~6个月,病程超过1年者仅10%。病程较长者可能由恶性程度低的星形细胞瘤演变而来。个别病例因肿瘤出血,可呈卒中样发病。由于肿瘤生长迅速,脑水肿广泛,颅内压增高症状明显,几乎全部病人都有头痛、呕吐、视盘水肿。有头痛(73%)、精神改变(57%)、肢体无力(51%)、呕吐(39%)、意识障碍(33%)与言语障碍(32%)。肿瘤浸润性破坏脑组织,造成一系列的局灶症状,病人有不同程度的偏瘫、偏身感觉障碍、失语和偏盲等。神经系统检查可发现偏瘫(70%)、脑神经损害(68%)、偏身感觉障碍(44%)与偏盲(39%)。癫痫的发生率较星形细胞瘤和少枝胶质细胞瘤少见,约 33 %的病人有癫痫发作。约20%的病人表现淡漠、痴呆、智力减退等精神症状。[收起]
胶质母细胞瘤生长速度快、病程短,70%~80%患者病程在3~6个月,病程超过1年者仅10%。病程较长者可能由恶性程度低的星形细胞瘤演变而来。个别病例因肿瘤出血,可呈卒中样发病。由于肿瘤生长迅速,脑水肿广泛,颅内压增高症状明显,几乎全部病人都有头痛、呕吐、视盘水肿。有头痛(73%)、精神改变(57%)、肢体无力(51%)、呕吐(39%)、意识障碍(33%)与言语障碍(32%)。肿瘤浸润性破坏脑组织,造成一系列的局灶症状,病人有不同程度的偏瘫、偏身感觉障碍、失语和偏盲等。神经系统检查可发现偏瘫(70%)、脑神经损害(68%)、偏身感觉障碍(44%)与偏盲(39%)。癫痫的发生率较星形细胞瘤和少枝胶...[详细]
如进行手术治疗,可能发生以下并发症: 1.颅内出血或血肿 与术中止血不仔细有关,随着手术技巧的提高,此并发症已较少发生。创面仔细止血,关颅前反复冲洗,即可减少或避免术后颅内出血。 2.脑水肿及术后高颅压 可用脱水药物降低颅内压,糖皮质激素减轻脑水肿。对于病变范围广泛或恶性程度高的肿瘤可尽可能多切除肿瘤及非功能区脑组织行内减压,同时去骨瓣外减压。 3.神经功能缺失 与术中损伤重要功能区及重要结构有关,术中尽可能避免损伤,出现后对症处理。
腰穿多提示压力增高,脑脊液蛋白含量增高及白细胞增多,少数病例特殊染色有时可发现脱落的肿瘤细胞。腰穿时病人颅内压较高应注意防止脑疝的形成。
1.放射性核素检查 诊断阳性率较星形细胞瘤为高,病变局部显示放射性浓区。头颅 X 线平片仅显示颅内压增高,偶见松果体钙化后的移位。脑血管造影见血管受压移位,约半数显示病理血管,病变处血管多粗细不均、扭曲不整,有的呈细小点状或丝状。 2.CT扫描 肿瘤呈边界不清的混合密度病灶,其中多有瘤内出血所致高密度表现但钙化者较少,瘤内坏死及囊性变呈低密度影,而使其形态呈多形性,病灶周围多数脑水肿较重,肿瘤与脑组织无明显边界。脑室常被压迫变小,变形或封闭,中线结构常向对侧移位。增强后95%的肿瘤呈不均匀强化,常表现为中央低密度的坏死或囊变区,周边增生血管区不规则的环形、岛形或螺旋形强化影(图1)。坏死区常位于肿瘤实质内,呈边界不整齐的低密度区。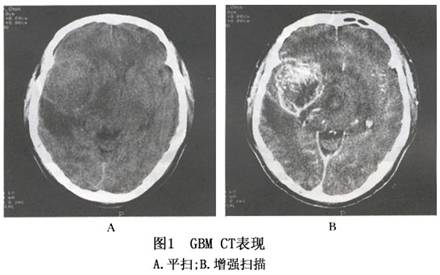 3.MRI检查 肿瘤在T1加权图像上呈低信号,T2W像为高信号的边界不清的肿瘤影(图2),与邻近脑组织不容易区分,占位效应十分明显。肿瘤内若有较大的坏死区则呈更低信号,若有出血呈高信号。胼胝体常受累,中线结构如纵裂池可变形、变窄或移位。肿瘤在T2加权像呈混杂信号,以高信号为主,散在性分布低与等信号。注射 Gd-DTPA 后肿瘤十分显著的对比增强使得肿瘤与邻近结构有明确的分界,且好发在脑深部,是较为特征性的表现。
3.MRI检查 肿瘤在T1加权图像上呈低信号,T2W像为高信号的边界不清的肿瘤影(图2),与邻近脑组织不容易区分,占位效应十分明显。肿瘤内若有较大的坏死区则呈更低信号,若有出血呈高信号。胼胝体常受累,中线结构如纵裂池可变形、变窄或移位。肿瘤在T2加权像呈混杂信号,以高信号为主,散在性分布低与等信号。注射 Gd-DTPA 后肿瘤十分显著的对比增强使得肿瘤与邻近结构有明确的分界,且好发在脑深部,是较为特征性的表现。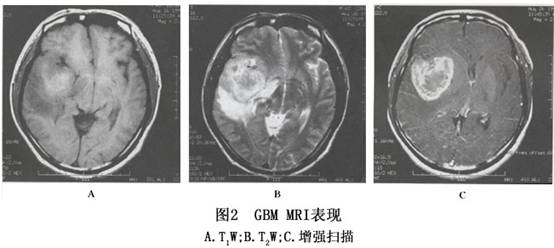 [收起]
1.放射性核素检查 诊断阳性率较星形细胞瘤为高,病变局部显示放射性浓区。头颅 X 线平片仅显示颅内压增高,偶见松果体钙化后的移位。脑血管造影见血管受压移位,约半数显示病理血管,病变处血管多粗细不均、扭曲不整,有的呈细小点状或丝状。 2.CT扫描 肿瘤呈边界不清的混合密度病灶,其中多有瘤内出血所致高密度表现但钙化者较少,瘤内坏死及囊性变呈低密度影,而使其形态呈多形性,病灶周围多数脑水肿较重,肿瘤与脑组织无明显边界。脑室常被压迫变小,变形或封闭,中线结构常向对侧移位。增强后95%的肿瘤呈不均匀强化,常表现为中央低密度的坏死或囊变区,周边增生血管区不规则的环形、岛形或螺旋形强化影(图...[详细]
[收起]
1.放射性核素检查 诊断阳性率较星形细胞瘤为高,病变局部显示放射性浓区。头颅 X 线平片仅显示颅内压增高,偶见松果体钙化后的移位。脑血管造影见血管受压移位,约半数显示病理血管,病变处血管多粗细不均、扭曲不整,有的呈细小点状或丝状。 2.CT扫描 肿瘤呈边界不清的混合密度病灶,其中多有瘤内出血所致高密度表现但钙化者较少,瘤内坏死及囊性变呈低密度影,而使其形态呈多形性,病灶周围多数脑水肿较重,肿瘤与脑组织无明显边界。脑室常被压迫变小,变形或封闭,中线结构常向对侧移位。增强后95%的肿瘤呈不均匀强化,常表现为中央低密度的坏死或囊变区,周边增生血管区不规则的环形、岛形或螺旋形强化影(图...[详细]
根据病史、临床表现及影像学检查,一般可以做出诊断。
胶质母细胞瘤以手术、放疗、化疗及其他综合治疗为主。手术应做到在不加重神经功能障碍的前提下尽可能多地切除肿瘤,扩大肿瘤切除范围既可以有效地内减压,又能减轻术后脑水肿,减低神经系统并发症的发生率。肿瘤约有1/3边界比较清楚,手术可做到肉眼全切除;另2/3呈明显浸润性,与正常脑组织分不出明显界限,如果位于额叶前部、颞叶前部或枕叶者,可将肿瘤连同脑叶一并切除,使术后有一个比较大的空间,这样效果较好。如果肿瘤位于重要功能区(语言中枢或运动中枢),为了不加重脑功能的障碍多数仅能做部分切除,对位于脑干、基底神经节及丘脑的肿瘤可在显微镜下严格做到切除肿瘤,手术结束时可做外减压术。据目前统计,胶质母细胞瘤的手术死亡率不到1%,术后神经系统并发症的发生率在10%以内。肿瘤复发后可再次手术,再次手术的死亡率及术后并发症均无增加。 每个患者均应行术后常规放疗,也可合并应用化疗或免疫治疗。近来有文献报道手术后即进行放疗,在放疗后每隔2个月化疗1次,同时予以免疫治疗,可使部分病人获得较长时间的缓解期。 胶质母细胞瘤表现一定的放疗耐受性,对于残余的肿瘤多采用高剂量分割照射、肿瘤间质内放疗和立体定向放射外科来实现。HFRT能将传统外放射剂量提高到70.2~72Gy,而不产生放射性坏死,增强了抑制肿瘤复发的能力。125I质粒的立体定向植入(间质内放疗)配合HFRT能够显著提高治疗效果,优于传统外放疗和化疗的组合。胶质母细胞瘤对不同的化疗敏感率是40%~80%,利用大剂量多种化疗药联合冲击治疗后辅助以自体骨髓移植来减少化疗副反应也证明是可行的。小儿胶质母细胞瘤术后3年内脑脊液播散率为(26±7)%,局部复发率为69%,二者同时发生也常见,对手术后辅以脑脊髓照射和局部追加照射也是可行的。近来,对胶质母细胞瘤的免疫治疗、基因治疗的报告也有许多,但因治疗方法和效果评价标准的不统一,效果均不十分肯定,只能作为综合治疗手段的一部分,无法代替放化疗。[收起]
胶质母细胞瘤以手术、放疗、化疗及其他综合治疗为主。手术应做到在不加重神经功能障碍的前提下尽可能多地切除肿瘤,扩大肿瘤切除范围既可以有效地内减压,又能减轻术后脑水肿,减低神经系统并发症的发生率。肿瘤约有1/3边界比较清楚,手术可做到肉眼全切除;另2/3呈明显浸润性,与正常脑组织分不出明显界限,如果位于额叶前部、颞叶前部或枕叶者,可将肿瘤连同脑叶一并切除,使术后有一个比较大的空间,这样效果较好。如果肿瘤位于重要功能区(语言中枢或运动中枢),为了不加重脑功能的障碍多数仅能做部分切除,对位于脑干、基底神经节及丘脑的肿瘤可在显微镜下严格做到切除肿瘤,手术结束时可做外减压术。据目前统计,胶质母细胞瘤的手术...[详细]
因肿瘤恶性程度高,术后易复发,胶质母细胞瘤患者预后差,95%未经治疗的患者生存期不超过3个月。患者的预后与多因素有关。患者年龄在45岁以下,术前症状超过6个月,症状以癫痫为主而非精神障碍,肿瘤位于额叶及术前状况较好者生存期稍长。肿瘤切除程度影响患者生存期,部分切除或行肿瘤活检者术后6个月及2年的生存率为肉眼肿瘤全切的患者的一半。肉眼肿瘤全切除对改善患者神经系统症状有帮助。放疗可延长患者的生存期4~9个月,术后放疗可使部分患者生存期达18个月。然而,虽然对胶质母细胞瘤的综合治疗可暂时缓解病情进展,但不能治愈肿瘤,胶质母细胞瘤患者经肿瘤肉眼全切、放疗、化疗等综合治疗后,2年生存率为10%,仅有不到5%的病人可长期生存。[收起]
因肿瘤恶性程度高,术后易复发,胶质母细胞瘤患者预后差,95%未经治疗的患者生存期不超过3个月。患者的预后与多因素有关。患者年龄在45岁以下,术前症状超过6个月,症状以癫痫为主而非精神障碍,肿瘤位于额叶及术前状况较好者生存期稍长。肿瘤切除程度影响患者生存期,部分切除或行肿瘤活检者术后6个月及2年的生存率为肉眼肿瘤全切的患者的一半。肉眼肿瘤全切除对改善患者神经系统症状有帮助。放疗可延长患者的生存期4~9个月,术后放疗可使部分患者生存期达18个月。然而,虽然对胶质母细胞瘤的综合治疗可暂时缓解病情进展,但不能治愈肿瘤,胶质母细胞瘤患者经肿瘤肉眼全切、放疗、化疗等综合治疗后,2年生存率为10%,仅有不到...[详细]


 3.MRI检查 肿瘤在T1加权图像上呈低信号,T2W像为高信号的边界不清的肿瘤影(图2),与邻近脑组织不容易区分,占位效应十分明显。肿瘤内若有较大的坏死区则呈更低信号,若有出血呈高信号。胼胝体常受累,中线结构如纵裂池可变形、变窄或移位。肿瘤在T2加权像呈混杂信号,以高信号为主,散在性分布低与等信号。注射 Gd-DTPA 后肿瘤十分显著的对比增强使得肿瘤与邻近结构有明确的分界,且好发在脑深部,是较为特征性的表现。
3.MRI检查 肿瘤在T1加权图像上呈低信号,T2W像为高信号的边界不清的肿瘤影(图2),与邻近脑组织不容易区分,占位效应十分明显。肿瘤内若有较大的坏死区则呈更低信号,若有出血呈高信号。胼胝体常受累,中线结构如纵裂池可变形、变窄或移位。肿瘤在T2加权像呈混杂信号,以高信号为主,散在性分布低与等信号。注射 Gd-DTPA 后肿瘤十分显著的对比增强使得肿瘤与邻近结构有明确的分界,且好发在脑深部,是较为特征性的表现。
 浙公网安备
33010902000463号
浙公网安备
33010902000463号



